Cụ thể, ngày 09/8/2016, Cục Quản lý Dược có công văn số 15360/QLD-CL gửi Sở Y tế các tỉnh, thành phố trực thuộc TW về việc công bố các cơ sở sản xuất thuốc đạt tiêu chuẩn PIC/S-GMP và EU-GMP đợt 43; Công văn số 15361/QLD-CL gửi các đơn vị có hồ sơ đề nghị công bố cơ sở sản xuất thuốc đạt tiêu chuẩn PIC/S-GMP và EU-GMP không đạt yêu cầu và cần bổ sung giải trình đợt 43
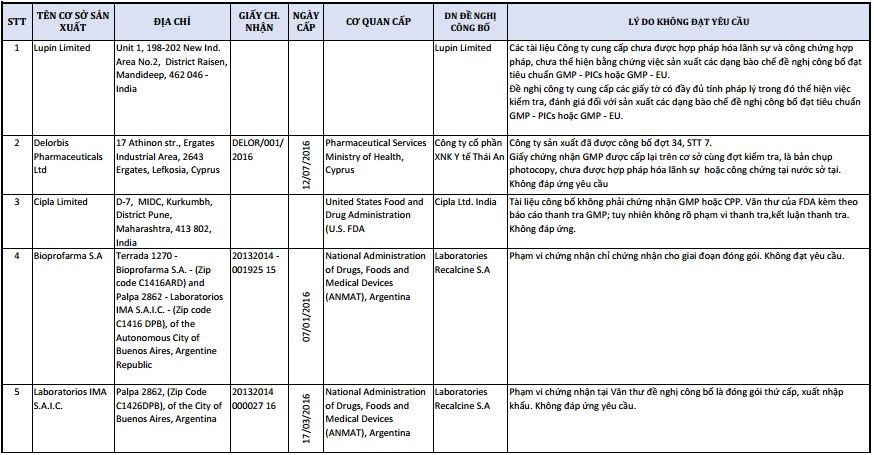
Danh sách 1 số đơn vị cung cấp dược không đáp ứng yêu cầu
Nhiều đơn vị đã vi phạm chứng nhận khi chỉ chứng nhận cho giai đoạn đóng gói hoặc vi phạm chứng nhận tại văn thư đề nghị công bố là đóng gói thứ cấp, xuất nhập khẩu,... không đạt yêu cầu.
Một số đơn vị khác mới chỉ cung cấp tài liệu photo, chưa được hợp pháp hóa dẫn đến vi phạm, chưa đáp ứng yêu cầu của Cục Quản lý dược.





.png)
.jpg)

.png)
.jpg)










